Pendahuluan
Setiap benda di sekitar kita, mulai dari air yang kita minum hingga udara yang kita hirup, tersusun dari partikel-partikel kecil yang disebut atom. Namun, sangat jarang atom berdiri sendiri. Umumnya, atom-atom saling bergabung membentuk molekul atau senyawa melalui suatu proses yang disebut ikatan kimia. Mengapa atom-atom itu perlu berikatan? Ternyata sudah sejak tahun 1902, sekitar 1 dekade sebelum Rutherford mengajukan model atom, ilmuwan G.N. Lewis dalam buku catatannya menggambarkan bagaimana ikatan kimia terbentuk antara atom-atom melalui skema pengisian elektron pada kulit terluar. Lewis secara umum mengatakan bahwa atom – atom yang berikatan akan mengikuti aturan oktet. Bagaimana cara mereka berikatan? Untuk memahami hal tersebut, kita harus mempelajari konsep ikatan kimia, tujuan atom membentuk ikatan, cara menggambarkan distribusi elektron melalui struktur Lewis, serta keterkaitannya dengan tabel periodik unsur.
(Silberberg, 4th edition)

Ternyata G.N. Lewis menuliskan ide mengenai aturan oktet dalam ikatan pertama kali di bagian belakang sebuah amplop, salah satu gambaran sketsa yang beliau buat adalah ikatan dalam molekul air (H2O).
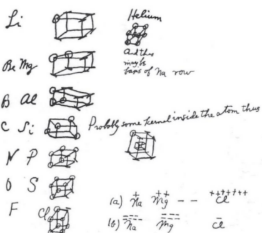
1. Definisi Ikatan Kimia
Ikatan kimia merupakan gaya tarik-menarik yang kuat antara dua atom atau lebih sehingga mereka tetap bersatu membentuk molekul atau senyawa. Ikatan ini terjadi akibat interaksi antara elektron-elektron di kulit terluar atom, yang disebut elektron valensi.
Bayangkan dua orang yang saling berpegangan tangan agar tidak terpisah. Demikian pula, atom-atom saling “berpegangan” melalui ikatan kimia agar tetap stabil. Tanpa ikatan kimia, atom-atom akan tetap terpisah dan tidak membentuk zat-zat yang kita kenal.
2. Tujuan Atom Membentuk Ikatan Kimia
Atom-atom di alam cenderung mencari kestabilan. Kestabilan ini dicapai ketika jumlah elektron di kulit terluar (elektron valensi) sesuai dengan konfigurasi elektron gas mulia. Menurut teori Lewis, atom – atom yang berikatan cenderung mengikuti Aturan Oktet agar stabil, yaitu atom – atom yang berikatan akan cenderung melepaskan, menarik atau memakai bersama elektron – elektron sehingga susunan elektron terluarnya berjumlah 8 (oktet) atau 2 (duplet) untuk atom H dan He. Gas mulia, seperti helium (He), neon (Ne), dan argon (Ar), dikenal sangat stabil karena kulit terluarnya sudah penuh.
- Aturan Oktet: Atom cenderung stabil jika memiliki 8 elektron di kulit terluar (seperti neon atau argon).
- Aturan Duplet: Untuk atom yang kulit terluarnya hanya memuat 2 elektron (seperti hidrogen dan helium), kestabilan dicapai bila kulit terluar berisi 2 elektron.
Proses Mencapai Kestabilan
Ide pokok / dasar teori G.N. Lewis antara lain :
- Elektron pada kulit terluar berperan penting dalam pembentukan ikatan
- Pada beberapa kasus, elektron akan diberikan dari satu atom ke atom lainnya sehingga terbentuk ion positif dan negatif yang berinteraksi secara elektrostatik membentuk ikatan ion
- Pasa kasus lainnya, elektron dari 2 atau lebih atom digunakan bersama – sama membentuk ikatan kovalen
Secara konsep atom mencapai kestabilan dengan beberapa cara:
- Melepas elektron (biasanya dilakukan oleh logam).
- Menangkap elektron (biasanya dilakukan oleh nonlogam).
- Berbagi elektron (antara sesama nonlogam).
Proses Kestabilan:
Berdasarkan Hukum Oktet, susunan elektron atom – atom yang stabil jika elektron valensi atom tersebut memiliki jumlah elektron 8 (oktet) sesuai konfigurasi elektron gas mulia atau berjumlah 2 (duplet) khusus untuk atom H dan He. Untuk memenuhi aturan tersebut, atom – atom dapat melepaskan elektron (membentuk ion positif), menerima elektron (membentuk ion negatif) maupun sharing elektron dengan atom lainnya
- Magnesium (Mg): Memiliki 2 elektron valensi. Agar stabil, magnesium melepaskan 2 elektron sehingga konfigurasi elektronnya menjadi seperti neon (Ne), sebuah gas mulia.
\mathrm{Mg} \rightarrow \mathrm{Mg}^{2+} + 2e^{-}
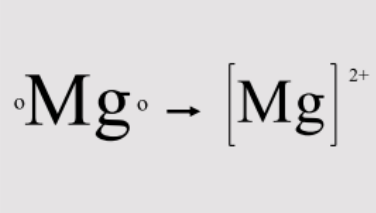
- Oksigen (O): Memiliki 8 elektron valensi. Agar stabil, oksigen menangkap 2 elektron sehingga kulit terluarnya menjadi 8 elektron, sama seperti argon (Ar).
\mathrm{O} + 2e^{-} \rightarrow \mathrm{O}^{2-}
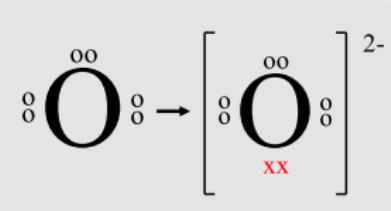
3. Elektron Valensi dan Struktur Lewis
A. Apa Itu Elektron Valensi-Struktur Lewis?
Elektron valensi adalah elektron yang terletak di kulit terluar atom dan berperan penting dalam pembentukan ikatan kimia. Jumlah elektron valensi menentukan bagaimana atom akan berikatan dengan atom lain.
Elektron valensi sering kali disimbolkan dalam struktur lewis. Struktur Lewis adalah cara sederhana untuk menggambarkan jumlah dan posisi elektron valensi di sekitar atom. Dalam struktur ini, simbol atom dikelilingi oleh titik-titik yang mewakili elektron valensi.
Simbol Lewis terdiri dari:
- Simbol atom yang menggambarkan inti dan elektron di dalam atom
- Dots / titik di sekitar atom menggambarkan elektron valensi atom
- Struktur Lewis merupakan kombinasi simbol Lewis dari beberapa atom yang menggambarkan transfer maupun pemakaian bersama elektron dalam pembentukan ikatan
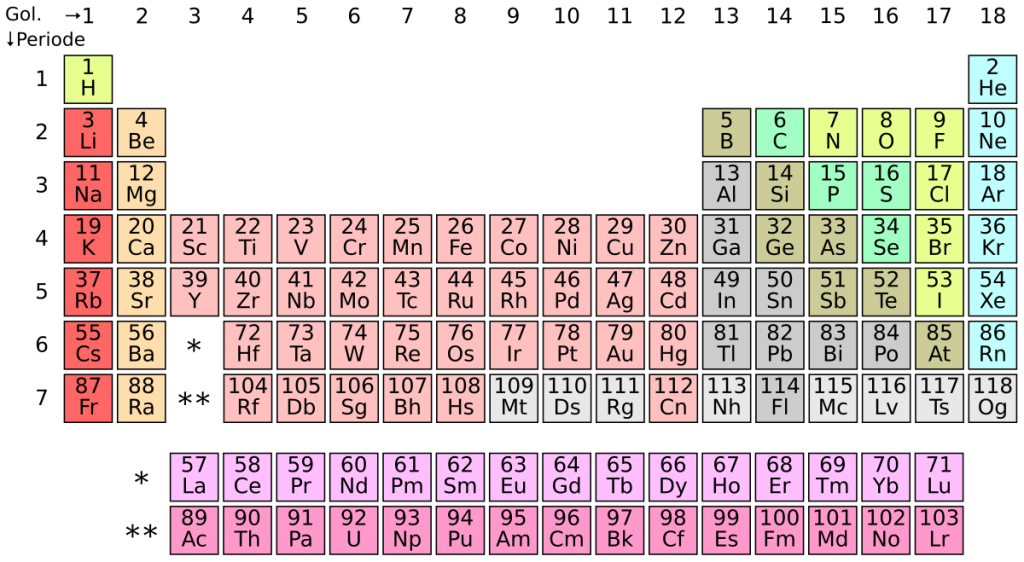
Tabel periodik unsur sangat membantu kita dalam menentukan jumlah elektron valensi suatu unsur. Unsur-unsur pada kolom (golongan) yang sama biasanya memiliki jumlah elektron valensi yang sama.

- Golongan IA (misal: H, Li, Na): 1 elektron valensi.
- Golongan IIA (misal: Be, Mg, Ca): 2 elektron valensi.
- Golongan IIIA (misal: B, Al): 3 elektron valensi.
- Golongan IVA (misal: C, Si): 4 elektron valensi.
- Golongan VA (misal: N, P): 5 elektron valensi.
- Golongan VIA (misal: O, S): 6 elektron valensi.
- Golongan VIIA (misal: F, Cl): 7 elektron valensi.
- Golongan VIIIA (gas mulia, misal: Ne, Ar): 8 elektron valensi (kecuali He, yang hanya 2).
B. Hubungan Elektron Valensi dengan Sifat Kimia
Unsur dengan jumlah elektron valensi yang sama memiliki sifat kimia yang mirip. Misalnya, semua unsur golongan IA sangat reaktif karena mudah melepaskan satu elektron, sedangkan unsur golongan VIIA sangat reaktif karena mudah menangkap satu elektron untuk mencapai kestabilan.
Contoh Soal
Atom aluminium memiliki nomor atom 13. Karena berada pada golongan IIIA (13) dalam tabel periodik, atom ini memiliki tiga elektron valensi. Untuk mencapai kestabilan, atom aluminium akan melepaskan ketiga elektron valensinya sehingga kulit terluarnya memiliki konfigurasi elektron stabil, yaitu oktet (seperti gas mulia neon). Dengan melepaskan tiga elektron tersebut, atom aluminium akan menjadi ion bermuatan positif (Al³⁺), sebagaimana ditunjukkan pada reaksi berikut:
\mathrm{Al} \rightarrow \mathrm{Al}^{3+} + 3e^{-}
“G.N. Lewis menjelaskan bahwa atom-atom berikatan untuk mencapai kestabilan. Umumnya, atom-atom tersebut berusaha memiliki susunan elektron terluar yang sama dengan gas mulia. Hal ini dikenal sebagai Aturan Oktet.”
Berdasarkan kutipan tersebut, manakah di bawah ini yang paling tepat menjelaskan mengapa atom-atom golongan VIIA sangat reaktif?
Unsur-unsur golongan VIIA memiliki 7 elektron valensi (hanya kurang 1 dari konfigurasi oktet yang stabil). Untuk mencapai kestabilan, unsur-unsur ini cenderung menangkap 1 elektron, yang menjelaskan mengapa mereka sangat reaktif—mereka mudah bereaksi untuk memperoleh elektron tambahan.


3 Responses
sangat membantu…
👍
bermanfaat..